今村祐嗣のコラム
木竹炭および木竹酢液の利用拡大
4.木炭のミクロな構造
木材を不活性雰囲気下で焼成したものの元素組成をみると、昇温とともに炭素含量が増加し、600℃を越えると炭素含量が90%以上に達します。しかしそれ以上の温度で加熱しても炭素含量はわずかずつ増えるものの、かなりの高温域に至っても酸素、水素の存在が木炭に認められ、完全な炭素単一素材になることはありません。石原の報告19)によれば、1000℃の焼成温度では炭素96.6%,水素0.5%,酸素2.9%であったとされています。
木材を加熱すると、質量減少が120~140℃付近から起こり始め、その後、セルロースは200~300℃、マトリックス成分であるリグニンは350~450℃で分解します。木炭の収率は300℃から400℃にかけて急速に減少し、450℃付近で最小となり、それ以上に温度を上げてもそれほど変化しなくなります。寸法変化の指標としての収縮率も、この温度域で著しく増加します。600℃で焼成した木炭は、焼成前の気乾状態の木材に比較して、接線方向で40%、放射方向で30%、長さ方向でも25%も収縮しています。木材構成成分の変換・分解と消失によって細胞壁が収縮し、木材(木炭)自身も収縮したと考えられます。

図―5 1000℃で炭化したスギ木炭のSEM写真6)
しかし、木材を3000℃まで焼成加熱しても、基本的な細胞形状や配列様式はほとんど変わりません。気体や液体の通導個所となるピットも木炭においても観察されます。しかしよくみると、ピット内部の壁孔膜は破壊されています。このことは、木炭の通導性を良くし、環境浄化材料としての機能の向上に寄与していると考えられます。
図5は600℃で炭化した針葉樹のスギの走査型電子顕微鏡(SEM)写真ですが、それぞれの樹種や材料固有の細胞構造を認めることができます6)。
さて、木炭の構造の特徴は細胞壁にあり、色々の機能の発現もそれと密接に関連しています。加熱に伴い、木材の強度を受け持っていたセルロース・ミクロフィブリルの結晶構造は崩壊し、木炭の破断面はきわめて平滑なガラス状の様相を示してきます。セルロースやリグニンの分解と並行して、熱力学的に安定な方向に炭素原子の再配列が生じ、黒鉛状の結晶構造に変化していく過程が推察されます20)。

図―6 700℃(右)および2490℃(左)で炭化あるいは焼結した木炭のTEM像21)
そこで、700℃・1時間で熱分解を行ったスギ木炭を透過型電子顕微鏡(TEM)によって直接観察したところ、様々な形状のナノカーボン構造が観察されました(図6)。その一つは、木炭の微粉末試料中に観察された、オニオン状炭素粒体です21)。さらに、高分解能TEMによって木炭中にダイヤモンド構造とともに、内部が空隙のオニオン状炭素粒体が観察されています22)。また、高分解能SEMによって、木炭細胞の内腔表面に黒点のように見えるものが観察され、平均径が約10nmであることから試料表面に存在する微細空隙メソ孔に相当すると考察されています。
5.木材組成の違いによる熱分解物への影響
木材の種類、すなわち樹種の違いによる熱分解物への影響は、固形物としての木炭よりもむしろ発生するガス、あるいはそれの冷却回収した木酢液や木タールの成分への方が大きいと考えられます。
スギ、ウバメガシ、モウソウチクを熱分解したところ、スギの熱分解液中にではフラン類、グアイアコール類、ケトン類、糖類が他の2樹種よりも多く検出されましたが、シリンゴール類のピークは検出されませんでした。ウバメガシ熱分解液ではフェノール類が3樹種の中では最も少なかったですが、一方、糖類のレボグルコサンとシリンゴール類が最も多く検出されました。モウソウチク熱分解液では酢酸やフェノール類が他の木材2種と比べて多く検出され、また、o-Ethyl phenolや4-Vinyl phenol等のフェノール類についてはモウソウチク熱分解液でのみ検出されました23)。
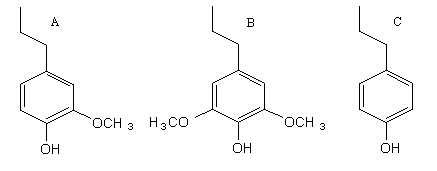 図―7 リグニンの基本骨格
図―7 リグニンの基本骨格
ところで、熱分解液中にはフェノール核をもつ化合物は多く検出されましたが、ベンゼン環に官能基が置換した化合物は検出されませんでした。このことはリグニンの基本骨格の中で、炭素原子と酸素原子との結合力(-C-O-)の方が、炭素原子同士の結合(-C-C-)力より熱に対して安定であることを示しています。また、得られたフェノール類の側鎖はmethyl基、ethyl基、propyl基、propenyl基、vinyl基といずれも炭素が3つ以下の置換基となっていることから、リグニン由来の芳香族化合物といえます。
芳香族化合物の相対濃度に差が現れる原因として、植物体を構成するリグニンの基本骨格が異なることが挙げられます。元来、針葉樹リグニンは主としてグアヤシルプロパン型(図―7A)で、広葉樹リグニンはグアヤシルプロパン型とシリンギルプロパン型(図―7B)であり、モウソウチクのような単子葉植物リグニンはグアヤシルプロパン、シリンギルプロパン型に加えパラヒドロキシフェニルプロパン型(図―7C)からなっています。また木材中のリグニンそのものの存在比も異なることから、リグニンの熱分解生成物であるグアイアコール類、フェノール類、シリンゴール類などの芳香族化合物の存在割合に差が出てくることは容易に推定されます。
脂肪族化合物で樹種間により差があるものに、酸類、フラン類およびケトン類があげられ、これらはセルロースおよびヘミセルロースの熱分解により生成すると考えられます。セルロースはグルコースがβ-1.4結合をした長鎖高分子ですが、ヘミセルロースの構造は針葉樹と広葉樹で異なっていますので、熱分解液中の脂肪族化合物の差も木材そのものの構成成分の差をあらわしていると考えられます。
5.おわりに
木質の炭化物としての“木炭”の機能性を追求していくためには、木質のみが備えている特徴を活かす工夫が大切でしょう。木炭が他の炭素材料と大きく異なる点は、木材固有の細胞構造に基づくミクロンオーダーの空隙の存在と配列であり、さらに炭化による細胞壁中でのナノオーダーでの空隙の形成です。前述したように、いくら高温で焼成しても木材が本来もっている細胞構造は維持されるものの、細胞壁の化学組成と微細構造は劇的に変化します。
水質や空気の浄化材料あるいは調湿材料などは、マクロおよびミクロレベルの空隙構造の存在がその性能の付与と向上に寄与しています。また、細胞の空隙を微生物のすみかとして活用しているものは、土壌改良材、水質浄化材のほか悪臭防除材料としての利用が行われています。
木炭の機能性の追求にあたっては、細胞の空隙構造による軽量性、連続多孔性、異方性あるいは種々の段階での複合化が可能なことなど、その特質を活かした工夫が考えられます。
文 献
2) 谷田貝光克ほか:木材学会誌、Vol.41、425-432(1995)
3) 谷田貝光克:林業技術、No.675、15-18(1998)
4) L.P. Novicio et al.:J. Wood Sci., Vol.44, 237-243(1998)
5) L.P. Novicio et al.:Wood Res., No.85, 48-55(1998)
6) 岸本定吉、橘田紘洋:木材学会誌、Vol.15, 208-213(1969)
7) 人見充則ほか:炭素、Vol.160, 247-254(1993)
8) 安部郁夫ほか:炭素、Yol.185, 277-284(1998)
9) 北村寿宏、田口 剛、片山裕之:木材学会誌、Vol.48, 272-279(2002)
10) 藤原 敏、嶋 一徹、千葉喬三:木材学会誌、Vol.49, 333-341(2003)
11) L.P. Novicio et al.:J. Wood Sci., Vol.47, 48-57(2001)
12) T. Furutuka et al.:Wood Res.,No.84, 46-49(1997)
13) 浅野典男ほか:第48回日本木材学会大会要旨集、p.661(1998)
14) 斉藤幸恵ほか:木材学会誌、Vol.46, 596-601(2000)
15) 日本住宅・木材技術センター編:”木炭を生かすー床下調湿資材としての木炭の活用-”pp.76、1997
16) 中山友栄:未発表
17) 鹿野厚子ほか:第51回日本木材学会大会要旨集、p.474、2001
18) 栗本康司、澤辺 攻:第45回日本学術会議材料研究連合講演論文集、pp.39-40、2001
19) 石原茂久:木材学会誌、Vol.42、717-723(1996)
20) K. Nishimiya et al.:J. Wood Sci., Vol.44, 50-61(1998)
21) T. Hata et al.:J Wood Sci., Vol.46, 89-92(2000)
22) K. Ishimaru et al.:J. Wood Sci., Vol.47, 414-416(2001)
23) 中井 祐:京都大学修士論文、2002
(2010年2月 ふくい農林水産支援センター研修会で講演)

